通常,一款新疫苗從開(kāi)始研發(fā)到成功上市,短則三五年,長(zhǎng)則十幾年。世界衛(wèi)生組織推測(cè),新冠病毒疫苗問(wèn)世需要12~18個(gè)月。為何它會(huì)比一般疫苗快?又為何不能更快些?這或許是同一個(gè)問(wèn)題。
冠狀病毒疫苗 | https://www.genengnews.com
作者 | 徐斯佳 日本京都大學(xué)醫(yī)學(xué)院
編輯 | 龍浩
疫苗是人類(lèi)戰(zhàn)勝重大傳染病的終極解藥。目前全球新冠病毒感染人數(shù)已累計(jì)超過(guò)400萬(wàn),新確診病例數(shù)以每日約8萬(wàn)人的速度持續(xù)增加中。
前期宣傳較好的幾種新冠“特效藥”最近陸續(xù)傳出負(fù)面消息,人們對(duì)疫苗成功研制的期盼與日俱增。
截至目前,全球共有8款新冠疫苗進(jìn)入了人體臨床試驗(yàn),其中4款來(lái)自中國(guó)。
世界衛(wèi)生組織推測(cè)新冠病毒疫苗問(wèn)世需要12~18個(gè)月。這比一般疫苗的開(kāi)發(fā)周期短很多。為什么它能比其他疫苗更快?又為何不能更快一些?
理解這個(gè)問(wèn)題,需要我們看到疫苗研發(fā)的多面:比如,已有的基礎(chǔ),不能跨越的規(guī)律。我們?cè)噲D全面梳理一下。
疫苗之難:服務(wù)龐大人群,注定萬(wàn)里挑一
藥物研發(fā)的成敗總?cè)Q于兩個(gè)關(guān)鍵:有效及安全。
疫苗是一類(lèi)非常特殊的藥物。它保護(hù)的是健康人群,數(shù)量較之患者可多出千萬(wàn)倍,因此合格的疫苗必須滿(mǎn)足更為嚴(yán)格的療效和安全性要求。
簡(jiǎn)單舉例,假設(shè)有2種疫苗,發(fā)生嚴(yán)重不良反應(yīng)的概率分別為0.1%和0.2%,乍一看數(shù)值都很低,但給1億人使用,影響人數(shù)就可能有10萬(wàn)人之差,顯然誰(shuí)都不想成為其中之一。
所以,能被大規(guī)模使用的疫苗都是經(jīng)歷重重考驗(yàn)、萬(wàn)里挑一的尖子。過(guò)去50年,有44種危害人類(lèi)健康的病原體被發(fā)現(xiàn),但只有6個(gè)疫苗成功上市。
病毒疫苗的研發(fā)大致有5個(gè)必經(jīng)階段:毒株分離測(cè)序→候選疫苗制備→動(dòng)物模型驗(yàn)證→人體臨床試驗(yàn)→量產(chǎn)投入使用。
通常,一款疫苗從研發(fā)到成功上市,短則三五年,長(zhǎng)則十幾年。對(duì)于新冠疫苗,世衛(wèi)組織的推測(cè)是12~18個(gè)月,比正常周期短很多。
對(duì)于這個(gè)估計(jì),有些人會(huì)想:這是否是以犧牲安全性為代價(jià)?另一些人則可能不解:眼下全世界的政策和資金都在支持研發(fā),各種頂尖機(jī)構(gòu)參與,為何還要等到明年?
兩個(gè)疑問(wèn)都有道理。
要回答這兩個(gè)截然相反的問(wèn)題,還是得從疫苗的研發(fā)流程說(shuō)起。
STEP1 毒株分離測(cè)序:“中國(guó)速度”創(chuàng)造歷史
俗話(huà)說(shuō),巧婦難為無(wú)米之炊。疫苗研制的第一步,是從患者樣本中分離出毒株,并獲得其全基因組序列。這是設(shè)計(jì)候選疫苗的原材料和必要參考。
得益于飛速發(fā)展的分離和測(cè)序技術(shù),中國(guó)科學(xué)家迅速響應(yīng),這一步以史無(wú)前例的速度完成了:首個(gè)感染病例被確診后僅1個(gè)月,1月11日,中國(guó)科學(xué)家便鑒定出病毒種類(lèi),并向世衛(wèi)組織共享了其全基因組序列。——當(dāng)年的SARS病毒,可是耗時(shí)了4個(gè)多月才獲得。
僅半個(gè)月之后,1月28日,國(guó)內(nèi)外多家機(jī)構(gòu)陸續(xù)分離出新冠病毒毒株,病毒的“個(gè)人檔案”被人類(lèi)掌握,各類(lèi)候選疫苗的篩選陸續(xù)啟動(dòng)。

病毒的全基因組序列是新疫苗研制的必要參考| hstoday.us
STEP2 制備技術(shù)大比拼:傳統(tǒng)方法更值得期待
有了原材料,下一步是選擇合適技術(shù)進(jìn)行疫苗的篩選和制備。
疫苗的原理,是模擬病原體特征,讓人體免疫系統(tǒng)提前來(lái)一場(chǎng)軍事演習(xí),產(chǎn)生戰(zhàn)斗記憶和抗體,這樣在未來(lái)病毒來(lái)襲時(shí)就能輕松應(yīng)對(duì)。所以無(wú)論技術(shù)新舊,都是變著法子引導(dǎo)人體認(rèn)出病原體,保證演習(xí)有效且安全地展開(kāi)。
怎樣才能達(dá)到這個(gè)目的呢?關(guān)鍵是對(duì)病毒特征的模擬。疫苗制備技術(shù)的進(jìn)步,可以說(shuō)是來(lái)自人類(lèi)對(duì)病毒拆解能力的不斷提升。
起初人們連分離毒株都很費(fèi)勁,為了預(yù)防天花,還曾拿病人皮疹上的膿液或結(jié)痂直接往健康人身上涂。
后來(lái)逐漸學(xué)會(huì)分離病毒,就開(kāi)始對(duì)其進(jìn)行加工,比如將其整體滅活,或減弱毒性,或僅提取其“零部件”,給免疫系統(tǒng)做演習(xí)之用。通過(guò)這些方法生產(chǎn)的疫苗,被歸為傳統(tǒng)疫苗。(分別對(duì)應(yīng):滅活疫苗、減毒活疫苗、亞單位疫苗)
后來(lái)出現(xiàn)的依托基因工程技術(shù)生產(chǎn)的核酸疫苗和載體疫苗,則不需要病毒真身參與,而是通過(guò)人工合成,就像復(fù)印了病毒的“身份證”,送入人體做備案,它們可以歸為新技術(shù)疫苗。
目前我國(guó)已有4個(gè)疫苗進(jìn)入臨床試驗(yàn),包括3個(gè)滅活疫苗和1個(gè)腺病毒載體疫苗,技術(shù)流程都比較成熟。而國(guó)外的幾個(gè)在試驗(yàn)疫苗則為核酸疫苗。
· 幾種常見(jiàn)疫苗 ·

滅活疫苗,也稱(chēng)死疫苗,是歷史悠久的傳統(tǒng)疫苗之一。原材料是病毒本身,通過(guò)物理或化學(xué)方法將病毒的蛋白質(zhì)凝固,去除其感染活性,但保留能被人體免疫系統(tǒng)識(shí)別的“外貌”特征。好比將兇狠的野獸制作成不會(huì)動(dòng)彈的標(biāo)本。其穩(wěn)定性和安全性比較可靠。但死疫苗在人體內(nèi)不能繁殖,對(duì)免疫系統(tǒng)的刺激時(shí)間短,需多次接種才能達(dá)到理想效果。(圖| 我國(guó)已進(jìn)入臨床試驗(yàn)的滅活疫苗之一,新華社)
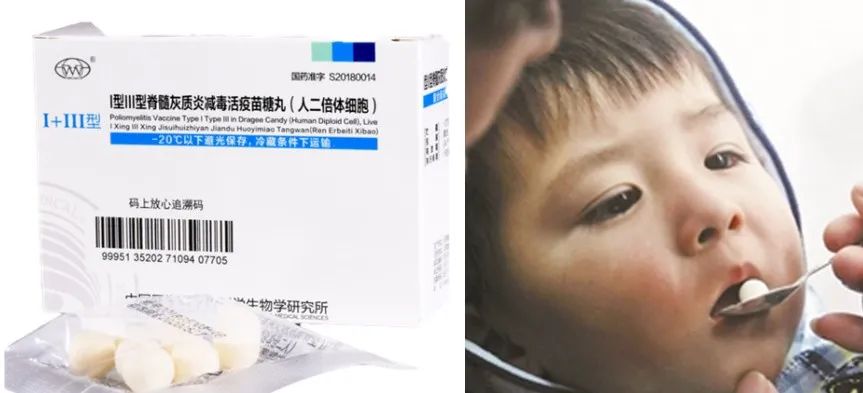
減毒疫苗可以彌補(bǔ)滅活疫苗的不足,它是保留了病毒復(fù)制能力的活疫苗,也是傳統(tǒng)疫苗研制的熱點(diǎn)。通過(guò)改變病毒的生存環(huán)境,例如,將病毒感染其他宿主細(xì)胞、或養(yǎng)在低溫環(huán)境中,再反復(fù)傳代,適應(yīng)了新環(huán)境的病毒對(duì)人體的毒性便逐代減弱。被減毒的病毒是活的,接種后能在體內(nèi)溫和繁殖,激發(fā)較持久的免疫反應(yīng)。接種次數(shù)少,副反應(yīng)輕微。我們所熟悉的麻疹疫苗、凍干水痘疫苗,還有小時(shí)候吃的“糖丸”脊髓灰質(zhì)炎疫苗,都屬于減毒活疫苗。它好處雖多,但畢竟是活疫苗,毒性有可能反強(qiáng),對(duì)老人兒童等免疫力較弱人群的安全性要仔細(xì)考量,篩選會(huì)更費(fèi)時(shí),因此這次率先進(jìn)入臨床試驗(yàn)的還是滅活疫苗。(圖| 小時(shí)候吃的“糖丸”疫苗,來(lái)自網(wǎng)絡(luò))
腺病毒載體疫苗,也是一種活疫苗,和減毒活疫苗頗有異曲同工之妙。疫苗中使用的是經(jīng)過(guò)人工改良的腺病毒,溫和不致病,但仍有自我復(fù)制能力。我們知道,新冠病毒是靠表面的特殊的棘突S蛋白入侵人體細(xì)胞的。腺病毒載體疫苗就是先將新冠病毒編碼S蛋白的基因插入改良腺病毒的基因組中,然后像一輛輛載貨的卡車(chē),被注射入人體。隨后它們每次復(fù)制,都會(huì)順帶把插入的新冠病毒S蛋白基因一起復(fù)制、編碼,給人體免疫系統(tǒng)練兵,產(chǎn)生針對(duì)的抗體。我國(guó)軍事科學(xué)院陳薇院士團(tuán)隊(duì)研制的腺病毒載體疫苗是全球首個(gè)進(jìn)入二期臨床試驗(yàn)的新冠疫苗,值得期待。
核酸疫苗,是國(guó)外機(jī)構(gòu)重點(diǎn)研發(fā)的疫苗,它不借助載體,直接將編碼病毒蛋白的核酸片段導(dǎo)入人體細(xì)胞,利用人體自己的細(xì)胞工廠,合成出蛋白,誘導(dǎo)免疫應(yīng)答。核酸疫苗的好處是成分簡(jiǎn)單,可以大量人工合成;缺點(diǎn)是核酸不穩(wěn)定,而且要依賴(lài)其他細(xì)胞環(huán)境把上游核酸變成下游蛋白,中間各個(gè)步驟可能受到諸多因素影響,不一定能成功引起免疫應(yīng)答。歷史上尚無(wú)核酸疫苗成功上市。多一種技術(shù)當(dāng)然多一份希望。
不同種類(lèi)疫苗各有優(yōu)缺點(diǎn),但無(wú)論用何種技術(shù), “有效”和“安全”都是判斷疫苗成敗優(yōu)劣的唯二標(biāo)準(zhǔn)。
就目前來(lái)看,傳統(tǒng)疫苗的制備工藝簡(jiǎn)單,技術(shù)路線(xiàn)成熟,競(jìng)爭(zhēng)力并不比新技術(shù)疫苗差,甚至更值得期待。
STEP3 動(dòng)物模型有基礎(chǔ),“庫(kù)存”小鼠直接用
試驗(yàn)疫苗制備完成之后,就要開(kāi)始篩選了。動(dòng)物模型(即代替人類(lèi)做“人體”試驗(yàn)的動(dòng)物)是篩選疫苗的重要工具。
對(duì)于一種新發(fā)疫情,找到感染癥狀和人類(lèi)相似的動(dòng)物通常很困難。好在新冠病毒和2003年的SARS病毒有很大相似性。它們都屬于冠狀病毒家族,都通過(guò)棘突蛋白S與人細(xì)胞表面的血管緊張素轉(zhuǎn)換酶2(ACE2)蛋白結(jié)合,繼而入侵人體細(xì)胞。
而當(dāng)年研究SARS病毒時(shí)發(fā)現(xiàn),科研中最常用的試驗(yàn)動(dòng)物——小鼠,由于物種特異性,不能自然感染SARS病毒。所以一開(kāi)始只能用昂貴的猴子,在國(guó)內(nèi)極少數(shù)特殊實(shí)驗(yàn)室中進(jìn)行研究。
直到后來(lái),用基因編輯技術(shù)構(gòu)建出了表達(dá)人類(lèi)ACE2蛋白的小鼠,并篩選出能模擬出類(lèi)似的肺部病變的感染條件,這才大幅改善了SARS病毒研究的成本和效率。
此次新冠疫情初期,尚沒(méi)有專(zhuān)一動(dòng)物模型之際,科學(xué)家們?cè)诖_認(rèn)了新冠病毒與SARS病毒的親緣性后,先借用SARS病毒易感小鼠來(lái)開(kāi)展疫苗的動(dòng)物驗(yàn)證,再次加快了候選疫苗的研發(fā)進(jìn)程。

動(dòng)物模型是篩選疫苗的重要工具| medicilon.com.cn
STEP4 人體(臨床)試驗(yàn)I-III期,不只是人數(shù)的遞增
候選疫苗通過(guò)動(dòng)物實(shí)驗(yàn)之后,就要進(jìn)入“實(shí)戰(zhàn)”了。
疫苗的人體試驗(yàn)通常分三期進(jìn)行。規(guī)模上至少需要數(shù)十人、數(shù)百人和千人級(jí)別。但其實(shí)每一期的意義和任務(wù)都不同,絕不只是人數(shù)上的差異。
首先,對(duì)一種初次在人體上測(cè)試的新藥來(lái)說(shuō),安全與否比確認(rèn)效果更重要。因此小規(guī)模的I期臨床試驗(yàn),主要任務(wù)就是判斷疫苗的人體安全性和可耐受劑量。通過(guò)給與梯度劑量(從少到多)的疫苗,觀察不良反應(yīng)和劑量的關(guān)系,并收集藥物在體內(nèi)的代謝信息,如吸收效率,有效濃度,代謝產(chǎn)物和排泄途徑等。
II期臨床試驗(yàn)承上啟下。這個(gè)階段會(huì)設(shè)置對(duì)照組。除了進(jìn)一步確認(rèn)不良反應(yīng)在數(shù)百人規(guī)模中的發(fā)生率,將重點(diǎn)考察疫苗的保護(hù)效果、確認(rèn)發(fā)揮最佳效果的疫苗劑型等,為III期試驗(yàn)的設(shè)計(jì)和給藥劑量等提供依據(jù)。
而III期臨床試驗(yàn)是疫苗是否能上市的決定性階段,也是法律規(guī)定的必經(jīng)環(huán)節(jié)。I、II期臨床試驗(yàn)最短各需要1個(gè)月完成,而III期臨床試驗(yàn)最短需要3~5個(gè)月完成。當(dāng)然,這是最順利的情況,實(shí)際上,由于各種未知與意外,III期臨床試驗(yàn)持續(xù)數(shù)年的情況十分常見(jiàn)。
理想的III期試驗(yàn)應(yīng)是在國(guó)內(nèi)外多處醫(yī)療中心開(kāi)展雙盲、對(duì)照試驗(yàn),因?yàn)椴煌赜蛉巳旱幕虿町悺⒏鳈C(jī)構(gòu)的檢驗(yàn)效應(yīng)等都可能影響疫苗的效果。III期試驗(yàn)的方案設(shè)計(jì)和實(shí)施要求最嚴(yán)格,難度也最高,歷史上許多項(xiàng)目都是在III期試驗(yàn)階段功虧一簣。
目前尚無(wú)新冠疫苗進(jìn)入III期試驗(yàn)。陳薇院士團(tuán)隊(duì)的腺病毒載體重組疫苗第II期試驗(yàn)的508個(gè)志愿者已經(jīng)注射完畢,預(yù)計(jì)本月揭盲。

III期臨床試驗(yàn)涉及極其復(fù)雜的科學(xué)設(shè)計(jì)| kknews.cc
STEP5 走向量產(chǎn):技術(shù)政策齊加速,歷史教訓(xùn)引深思
新冠疫苗的研發(fā)之所以能達(dá)到空前速度,有各種因素的助力:
技術(shù)進(jìn)步讓我們能更快分離出原始毒株,確定其基因組序列;依靠基因組序列,我們又迅速確認(rèn)了新冠病毒與SARS病毒的家族相關(guān)性,并借用SARS病毒的動(dòng)物模型,快速啟動(dòng)候選疫苗的制備和動(dòng)物試驗(yàn)。
由于疫情逼迫,各國(guó)政府和組織均對(duì)疫苗研發(fā)給予了最大程度的支持,包括資金傾斜、簡(jiǎn)化審批手續(xù)。比如,我國(guó)授予部分項(xiàng)目I期和II期合并臨床試驗(yàn)的許可,理論上可至少縮短1個(gè)月的進(jìn)程。這些都是迄今為止疫苗研發(fā)能達(dá)到的最快加速。
即使如此,我們卻可能再次面臨當(dāng)年SARS疫苗研發(fā)后期遇到的窘境:
隨著中國(guó)新確診病例趨零,適合疫苗III期臨床試驗(yàn)的本土環(huán)境將逐漸消失。如果病毒暴露條件不足,就無(wú)法判斷感染者數(shù)量的減少是否是疫苗起了作用。
如果III期研究只在國(guó)外疫情流行地區(qū)開(kāi)展,病毒暴露環(huán)境將是真實(shí)的,保護(hù)效果也易于觀察,但得到的數(shù)據(jù)并不能代表中國(guó)人群病毒暴露下的疫苗效力,得到的結(jié)論是否能被用于中國(guó)人群,也是一個(gè)疑問(wèn)。
有專(zhuān)家提出過(guò)替代方案,比如將歸國(guó)、出國(guó)人員等作為試驗(yàn)對(duì)象,或啟動(dòng)“應(yīng)急接種”,對(duì)海關(guān)、機(jī)場(chǎng)等特定場(chǎng)所的一線(xiàn)抗疫人員注射疫苗。這樣,病毒暴露環(huán)境就接近真實(shí)。
但依然存在樣本人數(shù)偏少、無(wú)法覆蓋全年齡層、歸國(guó)人員的隔離措施必須被迫放寬等問(wèn)題。
如果這些問(wèn)題無(wú)法得到合理解決,無(wú)疑將影響到III期試驗(yàn)的耗時(shí)和結(jié)果的準(zhǔn)確性。

確診人數(shù)趨零,可能導(dǎo)致無(wú)法開(kāi)展III期臨床試驗(yàn) | 來(lái)自網(wǎng)絡(luò)
另外,由于疫苗研發(fā)的周期非常長(zhǎng),經(jīng)常出現(xiàn)這樣的尷尬局面:病毒一來(lái),各種研究項(xiàng)目一哄而上、萬(wàn)眾矚目;病毒消停,則一哄而散,很多項(xiàng)目中途撤項(xiàng)、不了了之,造成巨大的資源浪費(fèi)。
如果新冠病毒最終成為像流感那樣的季節(jié)性流行病毒,那疫苗無(wú)疑將是最重要的防治措施。但即使沒(méi)有,從SARS、MERS到此次的新冠病毒也可以看出,冠狀病毒家族儼然已成為人類(lèi)的“老朋友”,鑒于病毒結(jié)構(gòu)的一脈相承,難保何時(shí)又有哪位家族成員一時(shí)興起,竄出來(lái)幫我們梳理人生。
因此有專(zhuān)家倡議,應(yīng)充分考量各個(gè)機(jī)構(gòu)設(shè)計(jì)疫苗和實(shí)現(xiàn)技術(shù)轉(zhuǎn)化的能力,集中資源繼續(xù)支持個(gè)別有希望出成果的項(xiàng)目,即使疫情消退也給予持續(xù)的支持,并重視廣譜冠狀病毒疫苗的研發(fā),為未知的危險(xiǎn)做準(zhǔn)備。
平靜安寧的日子是我們每個(gè)人的美好愿景,但確實(shí)不應(yīng)再心存僥幸。面對(duì)新的天災(zāi),疫苗總是姍姍來(lái)遲。經(jīng)此一役,各國(guó)想必已達(dá)成共識(shí):無(wú)論眼前還是往后,我們只能始終帶著嚴(yán)謹(jǐn)而敬畏的心態(tài),做好與無(wú)常疫病長(zhǎng)期作斗爭(zhēng)的準(zhǔn)備。
參考資料:
1、http://m.xinhuanet.com/2020-04/17/c_1125869116.htm
2、http://dl.gov.cn/yqfk2020/info/1049262_1071339.vm
3、趙愷.疫苗研究與應(yīng)用[M].人民衛(wèi)生出版社, 2013